Este texto es una extracto del Material Educativo PROFAM (MEP) de “Asma” (Autor: Pablo Jinich y supervisión editorial de Alejandrina Lo Sasso y Yamila Mahumud) utilizado en PROFAM (Programa de Educación Continua en Salud Familiar Ambulatoria y Comunitaria del Servicio de Medicina Familiar y Comunitaria, Hospital Italiano de Buenos Aires).
- Farmacología del asma
- Fármacos de control
- Fármacos de rescate
- Técnicas de aplicación de fármacos
- Características especiales de la administración de fármacos en niños
- Tratamiento de la fase aguda
- Tratamiento de la fase crónica
El objetivo del tratamiento del paciente asmático es controlar la enfermedad evitando las crisis y permitiendo una calidad de vida óptima para realizar sus actividades cotidianas y deportivas. Cuando los síntomas se exacerban, se debe estabilizar lo antes posible la función pulmonar, para evitar la pérdida del control y el agravamiento de la crisis y en última instancia la muerte del paciente.
Hoy en día disponemos de las medidas terapéuticas con las que se pueden lograr todos los objetivos del tratamiento. Para ello es importante individualizar en cada paciente los siguientes aspectos:
- Tipo y gravedad del asma.
- Recursos personales y familiares para seguir un tratamiento crónico.
- Grado de aceptación de la enfermedad.
- Grado de comprensión de los tratamientos.
- Posibilidad de automonitoreo.
- Condiciones sociales, patrones culturales, recursos económicos y condiciones laborales.
- Accesibilidad a los sistemas de salud.
El tratamiento farmacológico del asma varía según el grado de severidad de la misma y el estadio en que se encuentre el paciente. Se debe recordar que el asma es una enfermedad dinámica y que se debe adaptar el tratamiento según la evolución de la misma.
Farmacología del asma
A los fines docentes y prácticos, las distintas drogas que se usan en el asma pueden agruparse, según su acción y momento en que se utilizan, en drogas de control y drogas de rescate.
La medicación de control se utiliza, principalmente, en la fase estable de la enfermedad con el objetivo de prevenir y controlar la aparición de síntomas y crisis asmáticas. La acción principal de estas drogas está dirigida a disminuir la inflamación de la mucosa respiratoria y la hiperreactividad bronquial. Se considera drogas de control a los corticoides inhalatorios y a los inhibidores de los leucotrienos y al omalizumab.
La medicación de rescate se utiliza en la fase aguda de la enfermedad o cuando aparecen los síntomas. La acción principal de estas drogas es actuar sobre el broncoespasmo y estabilizar la función pulmonar para revertir los síntomas. Se considera drogas de rescate a los B2 adrenérgicos de acción corta (SABA por su sigla en inglés) como el salbutamol y fenoterol, los antimuscarínicos de acción corta (SAMA por su sigla en inglés) como el bromuro de ipratropio y a la aminofilina/teofilina, estás últimas casi en desuso.
Un lugar intermedio ocupan hoy los B2 adrenérgicos de acción larga (LABA por su sigla en inglés) ya que actualmente se los usa tanto en el control basal de la enfermedad como para el alivio rápido de los síntomas. El más utilizado en esta doble función es el formoterol por su comienzo de acción muy rápido (cinco minutos).
Existen además B2 adrenérgicos de acción ultralarga (u-LABA por su sigla en inglés) que se utilizan sobre todo en EPOC. El indacaterol y vilanterol. Otro grupo de medicamentos que en asma no son tan utilizados pero que sí lo son en EPOC son los antimuscarínicos de acción prolongada (LAMA por su sigla en inglés) como el tiotropio.
Les presentaremos ahora las siglas que agrupan estos medicamentos usadas actualmente en las guías y las drogas más utilizadas de cada grupo:
SABA: beta 2 agonistas de acción corta (fenoterol y salbutamol).
LABA: beta 2 agonistas de acción larga (formoterol, salmeterol).
u-LABA: beta 2 agonistas de acción ultralarga (indacaterol y vilanterol).
CI: corticoides inhalatorios (más adelante detallaremos las opciones)
SAMA: antimuscarínicos de acción corta (bromuro de ipratropio).
LAMA: antimuscarínicos de acción larga (glicopirronio y tiotropio).
En el apartado de tratamiento presentaremos el cuadro que sistematiza las opciones según la clasificación del asma. Algo importante a destacar es que en los últimos años los avances y modificaciones en el tratamiento del asma tuvieron como destinatarios a los pacientes con asma moderado o severo. En 2019 la guía GINA: Iniciativa Global para el asma o Global initiative for asthma (GINA, por su sigla en inglés) incorporó por primera vez en 30 años modificaciones en el tratamiento de los pacientes que se presenten con asma leve. Las nuevas recomendaciones se basaron tanto en cuestiones epidemiológicas como en nuevas evidencias clínicas:
- A pesar de no estar en control, los pacientes con asma leve tienden a usar los SABA como único tratamiento.
- A pesar de tener indicados corticoides inhalados (CI) junto a beta agonistas de acción prolongada (LABA) combinados en un único dispositivo y en forma reglada, un gran número de pacientes los usan en forma esporádica.
- En los últimos años se realizaron varios estudios randomizados (SYGMA 1, SYGMA 2 y NOVEL start) con el fin de evaluar la modalidad a demanda de los CI + LABA (especialmente con formoterol) así como el uso de CI en todos los pacientes asmáticos (independientemente de la categorización inicial).
- Estos estudios randomizados observaron un moderado efecto positivo en el control sintomático y un significativo menor número de crisis agudas por asma con el uso de CI + LABA tanto en forma reglada como a demanda en pacientes caracterizados como con asma leve.
Fármacos de control
Corticoides
Son potentes antiinflamatorios. Se pueden usar por vía inhalatoria, oral o endovenosa. Pese a no tener acción sobre la membrana del mastocito (fase aguda), administrados por largos períodos disminuyen el número de mastocitos de las mucosas respiratorias, disminuyendo la respuesta bronquial a los alergenos. Bloquean la fase de respuesta retardada y disminuyen la permeabilidad vascular en la inflamación.
Disminuyen la hiperreactividad bronquial cuando se usan por períodos prolongados (dos a tres meses), siendo mayor este efecto por la vía inhalatoria. Previenen y revierten la tolerancia a los SABA cuando éstos se utilizan por períodos prolongados.
El manejo del asma cambió radicalmente desde la aparición de los corticoides inhalatorios (CI) dado que administrados por esta vía, casi no tienen efectos adversos sistémicos. Están disponibles en el mercado la beclometasona, budesonida, ciclesonide y fluticasona. Si bien es difícil determinar la bioequivalencia de los diferentes corticoides inhalatorios disponibles, en líneas generales podemos decir que son similares en efectos terapéuticos y adversos a dosis bioequivalentes. (Ver cuadro 6).
Cuadro 6. Dosis de corticoides inhalatorias y sus equivalencias.
| Droga | Grupo etario | Dosis bajas (en μg/día) | Dosis intermedias (en μg/día) | Dosis altas (en μg/día) |
| Beclometasona | Adultos | 100 a 500 | 500 a 800 | más de 800 |
| Niños | 50 a 350 | 350 a 650 | más de 650 | |
| Budesonida | Adultos | 200 a 400 | 400 a 600 | más de 600 |
| Niños | 100 a 200 | 200 a 400 | más de 400 | |
| Flunisolida | Adultos | 500 a 1000 | 1000 a 2000 | más de 2000 |
| Niños | 500 a 750 | 750 a 1250 | más de 1250 | |
| Fluticasona | Adultos | 50 a 250 | 250 a 650 | más de 650 |
| Niños | 50 a 175 | 175 a 450 | más de 450 |
Los pacientes que reciben CI reducen la sintomatología diaria y nocturna, disminuyen la frecuencia y la gravedad de sus crisis, tienen menor tasa de internación, utilizan menor cantidad de drogas de rescate y menor cantidad de corticoides orales.
El efecto terapéutico antiinflamatorio de los CI se manifiesta plenamente luego de por lo menos 30 días y desaparece al retirarlos.
Se recomienda iniciar CI en todos los pacientes con asma ya que logran mejoría en los flujos y mejoría sintomática y disminución del número y severidad de las crisis. (Ver cuadro 7). Se recomienda que la forma de administración de CI sea mediante aerocámara ya que disminuye los efectos adversos y aumenta la cantidad de droga en el efector. Además, dado que se administran por lo general cada 12 horas, el paciente no tiene que llevar la aerocámara durante el día.
Cuadro 7. Indicaciones de corticoterapia inhalatoria
- Asma leve intermitente y leve persistente: bajas dosis
- Asma moderada persistente: dosis medias.
- Asma severa persistente: altas dosis
- Asma por ejercicio
Los efectos adversos más comunes son la candidiasis oral y la disfonía. Ambos disminuyen con el uso de aerocámaras y el enjuague de la boca posterior a la administración del aerosol. Existen reportes de mayor incidencia de cataratas con el uso prolongado de dosis medias y altas de CI.
Los efectos adversos sistémicos son raros y son dosis dependientes. Aparecen sólo en aquellos pacientes que usan altas dosis de CI y también disminuyen con el uso de aerocámara.
En los adultos, estudios a largo plazo no mostraron disminución de la densidad mineral ósea ni aumento del riesgo de fractura con los CI.
En niños que utilizaron altas dosis de CI se vio desaceleración en la velocidad de crecimiento, pero este punto es difícil de evaluar, ya que los pacientes con asma grave de por sí tienen alterada la velocidad de crecimiento y el mal control del asma interfiere más en el crecimiento que los CI.
Los corticoides sistémicos (CS) se usan para el manejo del asma, tanto en la fase crónica, como en la aguda. En la fase crónica sólo se deben usar en pacientes con asma grave, como droga de última elección, cuando no logra controlarse de otra manera el cuadro.
En la fase aguda está demostrado que son más efectivos que el placebo para disminuir la tasa de admisión y recaída. Están indicados para el manejo agudo de crisis moderadas y severas por vía oral o endovenosa (ambas vías son igual de efectivas). (Ver cuadro 8). Se recomienda utilizarlos lo antes posible dado que recién se demuestran beneficios en la sintomatología luego de 6 a 12 horas de que fueron administrados. Se recomienda utilizar dosis de 40mg de prednisona en adultos o 1mg kg/día en niños (dosis máxima: 40 mg/kg día).
Cuadro 8. Indicaciones de corticoterapia sistémica.
- Crisis asmática aguda moderada y severa.
- Alta de una guardia, en aquellos pacientes que se usó CI para el manejo en guardia, para evitar una recaída.
- Asma severa no controlada con corticoides inhalatorios en altas dosis, b2 adrenérgicos de acción prolongada e inhibidores de los leucotrienos asociados.
Cuando se utilizan CS en la guardia para revertir la crisis, el paciente debe recibirlos por lo menos durante los siete días siguientes, en dosis de 20 a 40 mg de prednisolona en adultos o 0.5-1 mg /kg día en niños por vía oral, para evitar las recaídas. Usados a estas dosis y por esta cantidad de tiempo no hace falta retirarlos gradualmente al suspender el tratamiento.
En pacientes en los que se perdió el control de la enfermedad (asma descontrolada), se puede indicar un curso de siete días de corticoides por vía oral con el objeto de ganar control.
Dado los efectos adversos del uso prolongado de corticoides, hay que utilizarlos el menor tiempo posible, a la menor dosis efectiva para controlar la sintomatología y monitorizando las utilidades terapéuticas.
Inhibidores de los receptores de los leucotrienos (IRL) y de la 5-lipooxigenasa y omalizumab
Los IRL que se utilizan en la práctica clínica son el montelukast y el zafirlukast, y el inhibidor de la 5-lipooxigenasa es el zileutón.
Ambos tipos de drogas disminuyen la respuesta inflamatoria de la mucosa pulmonar y son una alternativa a los CI como drogas de control aunque no de primera elección. Estudios aleatorizados controlados contra placebo en asma leve y moderada mostraron que incrementan entre un 7 a un 18% el VEF1, mejoran los síntomas (medido en una mejoría del 30% de puntajes o «scores» de síntomas), reducen el consumo de SABA adrenérgicos, reducen un 30 a un 60% la tasa de exacerbaciones y mejoran los puntajes de calidad de vida. Sin embargo, estudios controlados contra corticoides inhalatorios mostraron que son menos efectivos que estos para mejorar los parámetros funcionales.
Los IRL tienen efectos sinérgicos cuando se asocian a corticoides inhalatorios y disminuyen el consumo de éstos, teniendo la ventaja que se administran por vía oral.
El montelukast está aprobado para ser usado en mayores de un año y el zafirlukast para mayores de 7 años. El zileutón está aprobado para niños mayores de 12 años y puede elevar las transaminasas hepáticas. Por este motivo se deben monitorizar las mismas cuando se usa.
Omalizumab: este anticuerpo antiIgE es una opción terapéutica para aquellos pacientes con niveles séricos elevados de IgE y asma severa no controlada con CI y LABA. Se usa en mayores de 12 años. Es una droga relativamente nueva y de costo elevado. Su uso es resorte del especialista.
Fármacos de rescate
Agonistas B2 adrenérgicos de acción corta (SABA)
Los SABA son potentes broncodilatadores que estimulan la relajación del músculo liso de la mucosa bronquial. También estabilizan la membrana de los mastocitos y disminuyen la permeabilidad vascular de la microcirculación bronquial (fase aguda). No tienen efecto sobre la respuesta retardada a los antígenos, la hiperreactividad bronquial, ni la inflamación de la mucosa (fase crónica).
Los efectos adversos más comunes son: cefalea, temblor, taquicardia y palpitaciones. Pueden producir hipokalemia, hiperglucemia, broncoespasmo paradojal y arritmias cardíacas (raro).
La controversia que existió en la literatura sobre el aumento de mortalidad con el uso crónico de SABA, quedó superada desde que se combinan con CI para aliviar el componente inflamatorio de la mucosa pulmonar, quedando el SABA para droga demanda como drogas de rescate. El uso prolongado de SABA puede generar taquifilaxia (disminución de los efectos terapéuticos) y por este motivo se deben indicar siempre a demanda y no en dosis a intervalos fijos.
Entre los distintos tipos de SABA que existen (salbutamol, fenoterol, terbutalina, clembuterol, isoetarina) todos tienen similar eficacia clínica a dosis equivalentes, siendo los efectos terapéuticos y adversos los mismos.
La vía inhalatoria es la de elección y las dosis varían según los requerimientos desde 100 ug hasta 800 ug/día de salbutamol o sus equivalentes. La dosis por disparo (puff) de salbutamol es de 100 ug. Estas dosis son tanto para adultos como para niños. El comienzo de la acción es entre los 3 y los 5 minutos, el pico entre los 30 y los 60 minutos y la duración del efecto, de 4 a 6 horas.
Los SABA se pueden usar en aerosol, polvo seco o con nebulizadores. La efectividad de las diferentes formulaciones es similar cuando se utilizan con buena técnica de administración y en dosis equivalentes. En general, la dosis de la nebulización es diez veces superior a la que se utiliza con el aerosol (1mg de salbutamol solución equivale a 10 puff de 100 ug del aerosol). Si se dispone de una aerocámara para la administración en aerosol, la biodisponibilidad de la droga aumenta (ver luego). La vía oral no se recomienda debido a su absorción errática. Ver más en “tratamiento de la crisis aguda”.
Para el tratamiento de los síntomas fuera de las crisis agudas existe suficiente evidencia que demuestra que conviene administrar los SABA a demanda según las necesidades del paciente y no en forma reglada a intervalos fijos (la forma reglada puede inducir un aumento de la reactividad bronquial).
Los SABA utilizados por vía inhalatoria en las crisis agudas son más potentes broncodilatadores que la aminofilina y los SAMA.
Los B2 de acción prolongada (LABA) tienen un mecanismo de acción similar a los de acción corta pero, administrados por la vía inhalatoria tienen una duración de aproximadamente 12 horas, debido a su mayor tiempo de acción en el receptor beta adrenérgico. Existen en el mercado preparaciones en aerosol o polvo seco con igual efectividad clínica, de salmeterol y formoterol.
Hay buena evidencia acerca de que el uso de este tipo de drogas mejora los parámetros funcionales, disminuye el consumo de drogas de rescate, mejora los escores de calidad de vida y disminuye la tasa de consulta a guardia de los pacientes con asma que las utilizan. Por lo general, los LABA son drogas seguras y los efectos adversos son similares a los de los SABA de acción corta. Están indicados clásicamente como drogas de control en la fase estable para el manejo de asmáticos moderados persistentes que no logran controlar la enfermedad con dosis moderadas de CI. Aunque en la actualidad se los ha comenzado a utilizar también como medicamento a demanda, especialmente al formoterol que tiene un comienzo de acción muy rápido.
Los LABA siempre deben usarse junto con CI ya que algunos estudios demostraron un aumento de la mortalidad y del número de exacerbaciones por asma al utilizar salmeterol en forma prolongada sin CI. Este efecto no ha sido observado con preparados de LABA combinados con CI. Esto es particularmente importante en asma y no es así en la enfermedad pulmonar obstructiva crónica, en donde, si bien la monoterapia no está recomendada, sí se utiliza la doble broncodilatación (LABA + antimuscarínicos de acción prolongada). El efecto adverso más frecuente es la cefalea (10% de los usuarios). Luego con menor frecuencia pueden producir: congestión nasal, irritación orofaríngea o boca seca, tos hipertensión, edemas de miembros inferiores, mareos, insomnio, ansiedad, parestesias, hiperglucemia y dispepsia.
Las recomendaciones de las principales guías de manejo del asma sugieren, por tales motivos, que los LABA siempre deben utilizarse asociados a CI, en la menor dosis posible para mantener al paciente controlado por tiempo limitado y reevaluando periódicamente su indicación.
La dosis de salmeterol en niños mayores de tres años y adultos es de 50 a 100 ug cada 12 horas. La dosis de formoterol en niños mayores de cinco años y adultos es de 4.5 a 12 ug cada 12 horas.
Anticolinérgicos
Los anticolinérgicos (AC) antagonizan el efecto broncoconstrictor del parasimpático. El único AC que se utilizaba en el manejo del asma como droga de rescate era el bromuro de ipratropio, que forma parte de los antimuscarínicos de acción corta (SAMA). Recientemente se publicaron estudios de investigación muy promisorios con tiotropio como droga de control, pero hacen falta más estudios y experiencia para recomendar esta droga en el uso cotidiano.
Los AC que se utilizan para el manejo del asma no tienen efecto directo sobre la musculatura lisa de la mucosa bronquial ni sobre la respuesta retardada a los antígenos ni sobre el mastocito y son de lento comienzo de acción y tienen menor potencia broncodilatadora en el asma que los SABA. Tienen escasa absorción sistémica y no tienen efectos sobre el sistema nervioso central ni sobre el aparato cardiovascular. El uso prolongado no genera tolerancia.
Hay evidencia que muestra que el efecto broncodilatador del ipratropio es aditivo a los SABA de acción corta y por eso se utilizan en la guardia asociados para el manejo de crisis moderadas y severas.
El ipratropio se utiliza como droga de rescate por vía inhalatoria en gotas para nebulizar o aerosoles. El comienzo de acción es lento (pico de acción 60 minutos), pero la duración de la acción es prolongada (cuatro a ocho horas). La dosis por disparo es de 18ug. Se deben comenzar con dos a tres disparos cada seis horas o en gotas para nebulizar (dosis de 0.5 mg en adultos y de 0.25 mg en 5 cc de solución fisiológica en los niños).
Aminofilina y teofilina
La teofilina y su versión endovenosa, la aminofilina, tienen propiedades broncodilatadoras con un modesto efecto antiinflamatorio. No son efectivas como monoterapia y prácticamente ya no se usan.
Técnica de administración de los fármacos
La vía inhalatoria es la vía de elección para la administración de la gran mayoría de los fármacos utilizados en el tratamiento del asma. La ventaja de esta vía es la mayor rapidez de comienzo de acción, la menor cantidad de droga necesaria para similares efectos terapéuticos y la menor incidencia de efectos adversos. A dosis equivalentes, los fármacos administrados con aerosoles son igual de efectivos que cuando se utilizan con nebulizador. Con el nebulizador la mayor parte del fármaco no llega al sitio de acción, sea porque queda adherido a la máscara o porque se nebuliza al aire. Por eso la dosis que se utiliza con el nebulizador es diez veces superior a la de los aerosoles. Por esta razón recomendamos, siempre que sea posible utilizar aerosoles con cámaras espaciadoras (aerocámaras).
La gran mayoría de los pacientes que utilizan aerosoles los utilizan con una mala técnica de administración debido a que son dispositivos donde se requieren múltiples pasos para lograr una buena técnica. Es muy importante lograr una buena educación del paciente en su uso.
Existen tres pasos fundamentales que deben realizar los pacientes para lograr un buen uso del aerosol. El primero es agitar el aerosol ya que aumenta la cantidad de partículas de droga aerosolizadas, siendo la dosis que se dispara sin agitar menor a la medida deseada. Sólo el 10 a 12% de la dosis que dispara un aerosol llega al sitio de acción (pequeña vía aérea), el resto se deposita en la boca, faringe, laringe y gran vía aérea. Las partículas que llegan a la pequeña vía aérea son las de menor tamaño (1 a 5 micrones de diámetro) y son las que generan los efectos terapéuticos de las drogas. El hecho de disparar con la boca abierta y a tres o cuatro centímetros de distancia disminuye la cantidad de partículas de droga que se depositan en la gran vía aérea. Si el paciente no logra hacerlo de esta manera puede hacerlo disparando dentro de la boca.
El segundo paso fundamental es disparar coordinadamente con el inicio de la inspiración. Este es uno de los pasos donde más errores se comenten y más droga se pierde.
Es indistinto desde qué volumen pulmonar se parte al comenzar a inspirar; lo más importante es asegurarse de que el paciente logre coordinar el disparo con la inspiración y que sea lenta y profunda. Este es el tercer paso donde se pierde droga dado que al inspirar lentamente se genera menos flujo turbulento en las vías aéreas y se deposita menos droga en la gran vía aérea.
Los 3 pasos fundamentales para el uso de los aerosoles en forma correcta son: agitar el aerosol, disparar coordinadamente con la respiración y respirar lenta y profundamente durante el disparo.
Hay que llegar a la capacidad pulmonar total, dado que a mayor volumen movilizado mayor es la penetración periférica de la droga. Luego se debe retener la respiración 10 segundos para dejar llegar al sitio de acción a las partículas que llegan por gravedad y exhalar lentamente para eliminar la menor cantidad de partículas.
El enjuague de la boca elimina la droga que se deposita en fauces y disminuye efectos adversos.
Siempre que sea posible conviene utilizar los fármacos inhalatorios con cámaras espaciadoras.
El uso de aerocámaras aumenta la disponibilidad de droga en la vía aérea inferior, especialmente en pacientes que no logran coordinar el disparo con la inhalación (ej. ancianos y niños). Además, disminuye la incidencia de candidiasis oral, ronquera, tos y efectos adversos sistémicos. La técnica de uso es similar al aerosol, con la salvedad que se dispone de mayor tiempo para coordinar el disparo con la inspiración.
Cuando se usan SABA y CI simultáneamente, se debe utilizar primero el SABA y, luego de 15 a 20 minutos, el CI para lograr mejores resultados ya que el efecto broncodilatador del SABA permite un mejor ingreso de los CI al pulmón.
Si se utilizan dosis de SABA en las que se necesita administrar dos disparos, conviene esperar entre cinco y diez minutos entre disparo y disparo hasta que haga efecto la droga.
Si se utilizan CI y es necesario administrarlos en dos disparos, se debe realizar de a un disparo por vez. Se dispone de tres a cinco segundos durante los cuales la droga está en suspensión dentro de la aerocámara para inhalarla totalmente.
Si se usaron CI se debe hacer un enjuague de la boca con agua luego de la administración para prevenir candidiasis oral y ronquera.
Es importante educar y supervisar a los pacientes periódicamente en la técnica de administración de fármacos por vía inhalatoria.
Características especiales de la administración de fármacos en los niños
Siempre que sea posible, se debe tratar el asma por vía inhalatoria dado los mejores resultados clínicos y los menores efectos adversos sistémicos. Sin embargo, hay que tener en cuenta algunos aspectos importantes en el caso de los niños:
- Adquieren el registro de la respiración y diferencian entre inspiración y espiración recién alrededor de los 3 años de vida.
- Tienen vías aéreas de menor diámetro y movilizan menores flujos respiratorios.
- Existen cámaras con válvulas inspiratorias y máscaras faciales para lactantes y niños pequeños.
- El uso del nebulizador es una técnica muy difundida en los niños asmáticos. Sólo el 10% de la dosis es efectiva utilizando esta técnica. Se debe usar un flujo de 8 a 10litros/min, diluyendo la droga en 4ml de solución fisiológica. Se recomienda sólo para uso en guardia.
- Las cámaras espaciadoras pueden ser usadas correctamente por niños y lactantes tanto en el domicilio como en la guardia.
- Los niños menores de 10 años no pueden usar correctamente los aerosoles inhalatorios sin cámara espaciadora.
- La medicación administrada en polvo seco con dispositivos que se activan por la inspiración (Turbuhalers y discos requieren de flujos inspiratorios altos que se adquieren alrededor de los 5 a 7 años de edad).
Es importante adaptar la técnica de administración de fármacos inhalatorios de acuerdo a la edad del paciente.
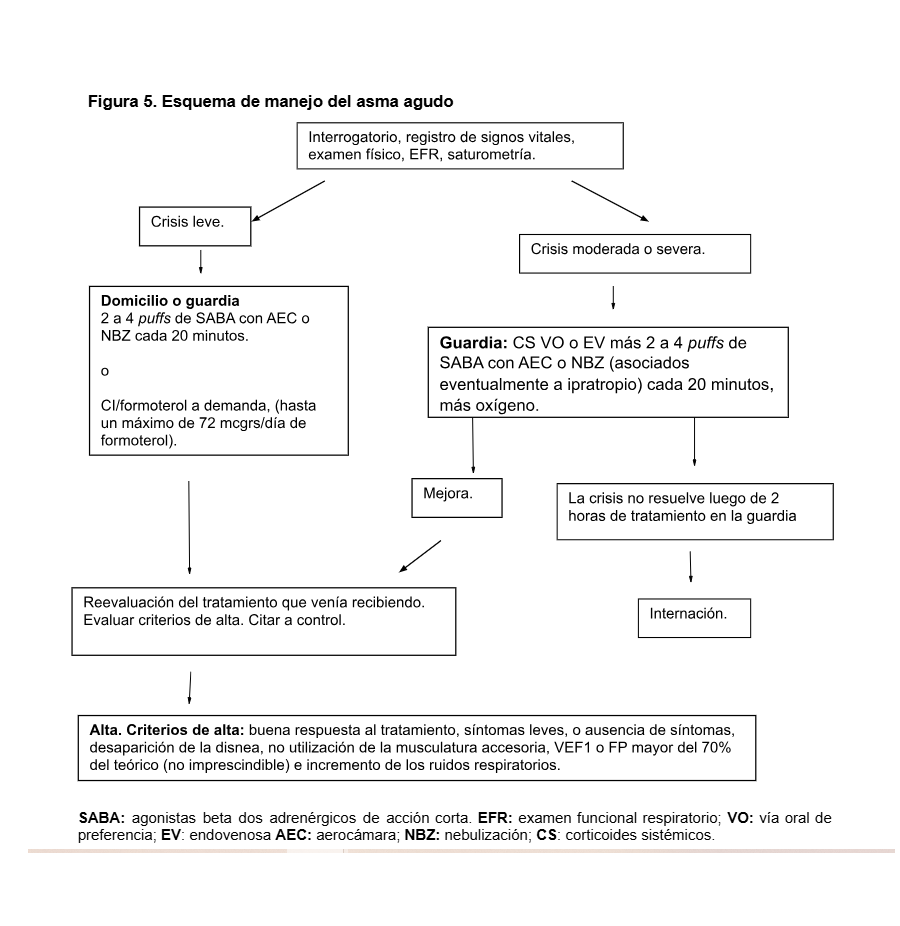
Tratamiento de la fase aguda
Las medidas terapéuticas en la fase aguda están dirigidas a controlar el broncoespasmo, así como evitar la muerte, la internación y la recaída. Cuanto más temprano se reconozca la crisis y se comience con el tratamiento, más fácil será el control de los síntomas.
La evaluación de la gravedad de la crisis suele ser muy dificultosa, sobre todo en niños pequeños, y el manejo del episodio agudo depende de ella. Dado que la evaluación de severidad de la crisis es compleja, conviene no subestimar la gravedad del cuadro. La crisis asmática que llega a una guardia debe considerarse una emergencia y por lo tanto es importante evaluar al paciente y comenzar el tratamiento lo más prontamente posible, tratando de evitar barreras administrativas y demoras innecesarias.
Si bien hay algunas controversias en la literatura, es recomendación de expertos indicar oxigenoterapia a todo paciente que ingresa a la guardia con una crisis asmática, con la finalidad de mantener la saturación de hemoglobina > al 90 %, (95% en embarazadas y pacientes cardíacos)
Todo paciente que llega a una guardia con crisis asmática debe recibir, dependiendo de la gravedad de la crisis, SABA por vía inhalatoria asociado o no a ipratropio y corticoides orales o endovenosos. Si no hay mejoría se deben repetir los SABA a los 20 minutos hasta completar tres dosis.
Hay buena evidencia que avala el uso de SABA administrados por vía inhalatoria en aerosol aún en pacientes graves, dado que es más rápida y segura. En lo que respecta a la forma de administración, se prefiere el uso del aerosol con aerocámara que es tan efectivo como el nebulizador y presenta menor tiempo de guardia y menor perfil de efectos adversos principalmente en niños.
La dosis salbutamol para nebulizar en adultos es de 2.5 a 5mg. Aclaramos que 2.5mg equivale a 10 gotas de solución para nebulizar o a 25 puff de aerosol (recordamos que sólo un 10% de la medicación nebulizada llega a su sitio de acción). La dosis en niños es de 0.15mg/kg o media a una gota por kilo de solución para nebulizar (dosis máxima: 5mg).
Otra opción en las personas con crisis leves (tanto en la guardia como en el domicilio) es que si ya usaban CI/formoterol para control/rescate lo aumenten hasta cuadriplicar la dosis habitual. Máximo de 72 mcg/día. Aquí también se recomienda la aerocámara.
Los pacientes que se presentan en la guardia con crisis moderadas y severas deben recibir además de los SABA adrenérgicos corticoides sistémicos (orales o endovenosos). En adultos se puede administrar 40-60mg de prednisona por vía oral o 200-500 mg de hidrocortisona por vía intravenosa con igual efectividad de ambas vías y dosis. En niños puede usarse prednisolona por vía oral en una dosis de 1 a 2mg/kg/dosis (máximo: 40 mg) o bien 10mg/kg de hidrocortisona intravenosa cada seis horas.
Los SABA deben seguir usándose en iguales dosis mientras se agregan los corticoides. La finalidad del uso de corticoides sistémicos en la guardia es evitar la internación y prevenir la recaída.
El empleo de aminofilina para el manejo del asma aguda no es un tratamiento de elección, y está recomendado actualmente como alternativa en asociación con corticoides sistémicos, ya que no mostró un beneficio adicional al uso de los agonistas beta2 de acción corta, y en cambio sí un aumento en la frecuencia de efectos adversos. Es importante tener presente el monitoreo de los niveles séricos de teofilinas en el caso de pacientes que la reciban de forma crónica, para prevenir su toxicidad.
Luego de dos horas de manejo de guardia, si no se ha logrado compensar al paciente se debe considerar su internación recordando que los SABA deben seguir usándose en iguales dosis mientras se agregan nuevas medidas.
No se recomienda el uso de mucolíticos ni terapia antibiótica de rutina (esta última quedaría reservada en caso de cuadros asociados con fiebre y esputo mucopurulento o para los casos confirmados de neumonía).
Los criterios de alta del tratamiento en la guardia y los de internación del paciente con una crisis asmática pueden verse en los cuadros 9 y 10.
Cuadro 9. Criterios de alta de la sala de emergencias de los pacientes con una crisis asmática
Criterios de Alta
- Buena respuesta al tratamiento
- Sin disnea
- Sin síntomas o con síntomas leves
- Cuadro estable a los 30-60 minutos del último tratamiento
- No uso de músculos accesorios
- Incremento de los ruidos respiratorios
- VEF1 o Flujo pico > 70% del basal
Cuadro 10. Criterios de internación de los pacientes con una crisis asmática
Criterios de internación
- Pacientes que no cumplen criterios de alta luego de dos horas de manejo en guardia
- Pacientes con crisis severas y/o potencialmente fatales
- Pacientes con criterios de alta pero con mal acceso al sistema de salud
En el momento del alta, y con el objeto de evitar la recaída, se debe indicar un curso de corticoides sistémicos durante 7 días en aquellos pacientes que habían requerido corticoides para estabilizar la crisis. Es importante dar por escrito al paciente un plan de acción a seguir en caso de recaída de los síntomas. También es importante pautar una consulta de seguimiento a las 24-72 horas, según el caso, para evaluar la evolución y replantear el tratamiento crónico. Algunas guías recomiendan comenzar con el tratamiento preventivo con corticoides inhalados desde el momento del alta.
La figura 5 muestra un algoritmo que esquematiza el manejo de la crisis asmática.
Tratamiento de la fase crónica
Las medidas terapéuticas en la fase crónica están dirigidas a disminuir la inflamación que existe en la mucosa bronquial de los pacientes con asma disminuyendo así la hiperreactividad bronquial y previniendo las exacerbaciones. Un aspecto importante de estas medidas es modificar los factores desencadenantes, aeroalergenos y los irritantes inhalatorios.
A los fines del manejo práctico, el asma se clasifica retrospectivamente según el nivel de tratamiento que requirió el paciente en el último mes para lograr controlar los síntomas y exacerbaciones, junto al número de episodios de síntomas diurnos semanales o nocturnos al mes.
Para el manejo farmacológico las categorías de asma leve, moderado y severo, si bien continúan vigentes, son reemplazadas por los conceptos de asma controlado, no controlado y con o sin factores de riesgo. (Ver cuadro 11). En el cuadro 12 se muestran los fármacos utilizados según el nivel de tratamiento.
Para evaluar el control del asma, tanto en el paciente con reciente diagnóstico como en el paciente ya conocido se debe indagar sobre:
- síntomas diurnos más de dos veces/semana.
- despertares nocturnos debido al asma.
- necesidad de utilizar medicación para el rescate más de dos veces/semana.
- limitación en la actividad debido al asma.
Un control deficiente de los síntomas interfiere en la calidad de vida de los pacientes y constituye un factor de riesgo para el desarrollo de crisis asmáticas. Además, existen factores independientes que aumentan el riesgo de presentar exacerbaciones (crisis asmáticas), deterioro de la función pulmonar o efectos secundarios de la medicación aun cuando los síntomas están controlados. Entre estos factores se encuentran:
- comorbilidades del paciente: tabaquismo, alergias respiratorias, obesidad.
- no uso de CI, o falta de adherencia a los tratamientos indicados.
- uso de más de un aerosol de 200 dosis de beta agonistas de acción corta (SABA) al mes (predictor de mortalidad).
- antecedentes de crisis severas.
- factores socioeconómicos adversos.
- Función pulmonar: FEV1, bajo, especialmente cuando es menor de 60% del valor teórico.
La presencia de varios de estos factores deberá guiar la indicación del tratamiento inicial así como la evaluación del tratamiento que ya está recibiendo el paciente. Considerando utilizar el paso siguiente al que otorga la evaluación “inicial” según síntomas y medicamentos utilizados.
La Guía GINA de 2019 propone las siguientes modificaciones para el inicio del tratamiento: se recomienda el uso de CI para todos los pacientes diagnosticados con asma. La elección del tratamiento inicial, es decir para aquellos pacientes que han sido diagnosticados recientemente con asma, tendrá que ver con la disponibilidad de los medicamentos y la frecuencia de los síntomas de paciente, así como con sus factores de riesgo y comorbilidades.
Las opciones incluyen:
- CI junto a SABA a demanda (que el paciente los use cuando tiene tos, disnea, sibilancias).
- CI-formoterol a dosis bajas a demanda.
- CI o CI-LABA (formoterol o salmeterol) reglados todos los días, más SABA a demanda.
- Tratamiento de mantenimiento y de rescate con CI-formoterol, y rescate con la combinación budenosida-formoterol o beclometasona-formoterol a dosis bajas.
Cuadro 11. Clasificación de asma y niveles de tratamiento
Características clínicas | Tratamiento | |
Asma leve | Hasta 2 episodios de síntomas leves por semana. Hasta 2 episodios de síntomas nocturnos por mes. Uso de medicación de rescate hasta 2 veces a la semana. Los síntomas no interfieren con la vida diaria. Los síntomas no interfieren con la actividad física. Ninguna crisis severa o uso de corticoides orales por año. | Nivel 1 Nivel 2 |
Asma moderado | Más de 2 episodios de síntomas diurnos por semana. Más de 3 o 4 episodios de síntomas nocturnos por mes. Uso de medicación de rescate más de 2 veces por semana. Leve compromiso de la vida cotidiana. Dos o más crisis por año que requieren corticoides orales. | Nivel 3 Nivel 4 |
Asma severo | Síntomas diarios o continuos. Necesidad diaria de medicación de rescate varias veces en el día. Limitación de la actividad cotidiana y física. Exacerbaciones muy frecuentes. Síntomas nocturnos muy frecuentes. Crisis que requieren internación. | Nivel 5 |
Cuadro 12. Niveles de tratamiento para el asma crónica
| Nivel 1 | Nivel 2 | Nivel 3 | Nivel 4 | Nivel 5 | |
| Medicación de control. | CI/formoterol en un mismo dispositivo a dosis bajas a demanda*. | CI a dosis bajas reglado o CI/formoterol (mismo dispositivo a demanda). | CI/LABA a dosis baja reglados (mismo dispositivo). | CI/LABA a dosis intermedias reglados (mismo dispositivo). | CI/LABA a dosis altas reglados (mismo dispositivo) e interconsulta a neumonología para mayor evaluación. |
| Otra opción de medicación de control. | CI a dosis bajas cada vez que se utilice el SABA. | IRL o CI a dosis bajas cada vez que se utilice el SABA. | CI a dosis intermedia reglados o CS + IRL a dosis bajas. | CI a dosis altas reglados + tiotropio o IRL. | Agregar dosis baja de CS pero considerar efectos secundarios. |
| Medicación de rescate. | CI/formoterol a dosis bajas a demanda. | CI/formoterol a dosis bajas a demanda (si usamos esta combinación para rescate el LABA de control también debe ser formoterol). | |||
| Otra opción de medicación de rescate. | SABA a demanda. | ||||
SABA: agonistas beta 2 adrenérgicos de acción corta; CI: corticoides inhalatorios; CS: corticoides sistémicos; IRL: Inhibidores de los receptores de los leucotrienos; LABA: agonistas beta 2 adrenérgicos de acción prolongada. * a demanda: significa que el paciente utiliza la medicación según su percepción de necesidad: tos, disnea, sibilancias. El símbolo “+” significa la sumatoria de dos medicamentos, el símbolo “/” indica dos medicamentos en un mismo dispositivo.
En el mercado existen formulaciones que asocian budesonide (CI) + formoterol (LABA) en el mismo dispositivo y pueden usarse como único tratamiento (control/rescate) tanto en el asma leve a demanda como en el asma moderada de manera reglada. Estos dispositivos tienen la ventaja de que con el mismo aparato se puede administrar toda la medicación pero la desventaja es su elevado costo.
La reciente evidencia que muestra que todos los pacientes con asma se beneficiarían de recibir desde el inicio CI levanta algunas preguntas en relación a: 1) ¿qué hacer con los pacientes con asma leve intermitente que están bien controlados con SABA a demanda? Nosotros pensamos que no haría falta modificar el tratamiento siempre que el paciente no tenga exacerbaciones. Ante la ocurrencia de la misma es posible que se deba iniciar la terapéutica con CI. 2) ¿es la terapéutica inicial con dos drogas (CI + SABA o CI/LABA) costoefectiva? No lo sabemos, y probablemente no se obtenga esta evidencia dado que ya se ha demostrado que el tratamiento combinado reduce las exacerbaciones por asma y mejora el control en los pacientes con asma leve. Nos preocupa el costo de bolsillo que pueda sufrir el usuario, pero es posible que la reducción de costos para el sistema sea significativa (al disminuirse las internaciones). Esta opción sólo será posible si el paciente, claro está, puede acceder de alguna manera a la medicación (sea comprándola o recibiéndola a través del sistema de salud)
Como se mencionó anteriormente, si están disponibles podría monitorizarse al paciente con pruebas funcionales respiratorias en determinadas situaciones como son antes y después de instaurar o modificar un tratamiento farmacológico y/o cada uno o dos años en pacientes estabilizados, entre otras. También es válida la evaluación clínica de la efectividad del tratamiento instaurado ya que si después del tiempo necesario de acción de cada droga no se logra controlar los síntomas o persisten las crisis nocturnas, deberá progresarse en los esquemas.
Antes de cada cambio de la terapéutica instaurada se debe evaluar el grado de comprensión y adherencia al tratamiento, la técnica de administración y la posibilidad de optimizar la biodisponibilidad de la droga dependiendo de cada situación incorporando aerocámaras o polvos secos.
Luego de un período de tres meses a seis meses de control de la enfermedad se debe reevaluar el tratamiento y se podrá plantear el descenso progresivo en los esquemas terapéuticos hasta lograr mantener al paciente controlado con la menor dosis y número de drogas posibles. Considerando que actualmente se propone que todos los pacientes con asma reciban dos drogas: un CI y un broncodilatador.
Los pacientes que presentan síntomas de asma sólo al realizar ejercicio también deben recibir CI. Para el manejo preventivo de la sintomatología del asma por ejercicio se pueden utilizar SABA de acción corta (100 ug de salbutamol) diez minutos antes de comenzar la actividad física. También se podrá utilizar un disparo de CI/formoterol antes de realizar ejercicio.
Ante un cuadro infeccioso respiratorio se debe evaluar y aumentar la medicación para prevenir la exacerbación.
![]()

